伦理审查体系管理规范
第一章 总则
第一条、为保护涉及人的医学研究受试者的权益和安全,规范我院伦理审查体系的管理,制定本管理规范。
第二条、伦理审查和研究活动应遵循《中华人民共和国医师法》(2021),《中华人民共和国药品管理法》(2019),《中华人民共和国药品管理法实施条例》(2002,2019修订),国家药品监督管理局《药品注册管理办法》(2020)、《药物临床试验质量管理规范》(2020)、《药物临床试验伦理审查工作指导原则》(2010)、《医疗器械临床试验质量管理规范》(2022),卫生健康委等《涉及人的生命科学和医学研究伦理审查办法》(2023),《药品不良反应报告和监测管理办法》(2011),国家中医药管理局《中医药临床研究伦理审查管理规范》(2010),国务院《医疗器械监督管理条例》(2021),国家药品监督管理总局《医疗器械注册管理办法》(2014),以及ICH GCP,《赫尔辛基宣言》,CIOMS《涉及人的健康相关研究国际伦理指南》(2016)等法律、法规、政策和指南。
第三条、所有我院承担的、以及在我院内实施的以人为受试者或者使用人(统称研究参与者)的生物样本、信息数据(包括健康记录、行为等)开展的医学研究,应向伦理委员会提交伦理审查申请/报告。
第四条、医院委派1名了解伦理审查体系管理相关的法律、法规、政策和指南的高层领导作为伦理审查体系建设负责人。医院职能管理部门,伦理委员会和伦理委员会办公室,临床专业科室和研究人员应履行伦理审查体系的相关职责,分工协作,保护受试者。
第二章 医院职能部门
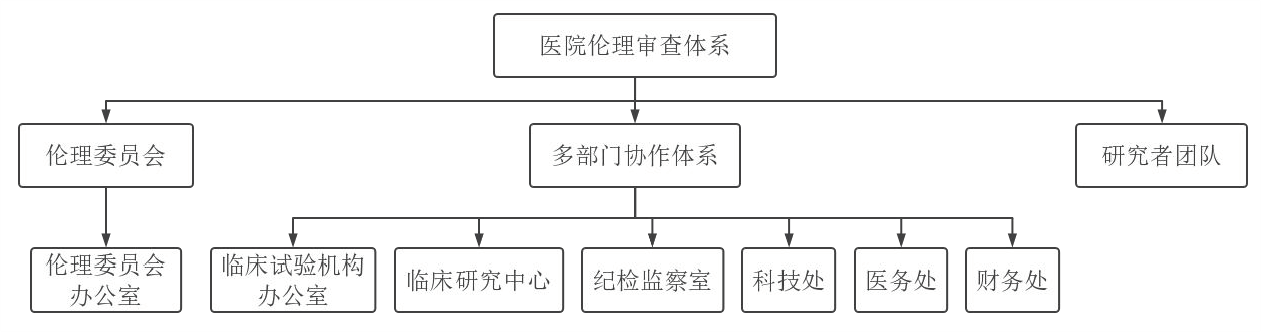
第一条、研究项目的管理
一.科技处、临床研究中心综合办公室的职责:
1 本院所有涉及人的医学研究科研课题均应经科技处(纵向课题)、临床研究中心综合办公室(横向课题、院内课题)立项审核,并批准同意。
2 科研课题在立项审核、研究合同/任务书审签盖章环节,告知研究者涉及人的医学研究必须获得伦理委员会的批准后才能启动。
3 对科研课题中期检查的内容应包括提交伦理跟踪审查的情况。
4 科研课题结题要求归档伦理审查的批件/意见、受试者知情同意书。
5 发现科研课题在没有经过伦理审查批准、没有获得受试者知情同意的情况下开展研究,则中止该项研究,并不允许利用所获得的所有数据。
6 论文发表后,如论文内容涉及人的医学研究,由论文第一完成人向科技处提交伦理批件进行备案。
二.药物临床试验机构办公室的职责:
1 所有药物/医疗器械临床试验项目均应经药物临床试验机构办公室审核,并批准同意。
2 临床试验项目启动会前审核确认该项目获得伦理委员会批件。
3 临床试验项目要求归档伦理审查的批件/意见、受试者知情同意书。
4 发现临床试验项目在没有经过伦理审查批准、没有获得受试者知情同意情况下开展,要求中止该项研究,并上报伦理。
5 负责研究人员的资格管理,要求所有研究人员必须经过GCP培训。没有经过培训的人员不能承担和参加药物/医疗器械临床试验项目。
第二条、研究利益冲突管理
一.纪检监察室(审计处)的职责:
1 对违反研究利益冲突政策或者科研学术道德失范的问题线索,移送纪检监察室调查处置。
第三条、研究合同管理
一.主要研究者/课题负责人的职责:
1 负责研究合同的起草。
2 提交管理部门审核。
3 签署合同并承担相应的责任。
二.研究管理部门的职责:
1 科技处、临床研究中心综合办公室负责科研课题的立项审核。
2 药物临床试验机构办公室负责药物和医疗器械临床试验的立项审核。
三.法律事务办公室的职责:
1 根据医院的相关合同管理规定对临床试验合同进行合法性审查。
四.法人代表或法人代表授权者的职责:
1 负责审签合同。
第四条、研究经费管理
一.计划财务处(绩效办公室)的职责:
1 负责研究经费的资金管理工作。
2 负责研究经费的会计核算工作。
3 负责研究经费的财务报销工作。
二.纪检监察室(审计处)的职责:
1 对研究经费使用进行监督,根据相关部门要求开展审计。
第五条、培训管理
一.科技处的职责:
1 负责制定科研项目研究者的年度培训计划与预算。
二.药物临床试验机构办公室的职责:
1 负责制定临床试验项目研究人员的年度培训计划与预算。
三.医务处的职责:
1 负责组织青年医师培训,在培训中列入GCP和受试者保护的内容。
第六条、质量管理
一.伦理委员会办公室的职责:
1 医院伦理委员会办公室负责伦理审查体系的质量管理,指定一名内审员,采用事先制定的检查清单,定期(每年1次)评估研究伦理审查体系相关的管理部门、研究部门和伦理委员会对法律、法规和指南的依从性,对组织机构政策/规章制度、程序的依从性。及时向体系相关部门反馈检查评估结果,并对其改进报告进行跟踪评估;必要时建议修订相关制度与操作程序,以改进伦理审查体系运行的质量。伦理委员会应接受卫生行政部门、药品监督管理部门的监督管理,接受独立的第三方质量认证。
第三章 伦理委员会/伦理委员会办公室
第一条、伦理审查
一.伦理委员会的职责:
1 对所提交的涉及人的医学研究项目进行科学性、伦理合理性审查。
2 审查研究者具有相应的研究资格,没有经过GCP培训的人员不能批准其承担研究项目。
第二条、伦理审查的管理
一.伦理委员会办公室的职责:
1 审核所提交审查的项目是否属于伦理审查的范围。
2 伦理审查批件/意见传达至申办者、主要研究者、科技处/临床研究中心综合办公室/药物临床试验机构办公室。
3 编制委员与秘书的年度培训计划与预算。
4 在医院网站公布本机构伦理委员会组成信息与联系方式,伦理审查的程序,批准研究的标准。
5 在医院网站设置“受试者之家”栏目,包括研究及研究伦理的科普知识,受试者抱怨等内容。
6 在医院网站设置“伦理审查体系”栏目,包括受试者保护体系的介绍;研究者培训资料。
第四章 研究人员
第一条、研究设计
一.主要研究者的职责:
1 按照专业科学原则和风险最小化原则组织设计研究方案。
第二条、研究项目的组织实施
一.主要研究者的职责:
1 新药和医疗器械临床试验主要研究者应具有副高或其以上的职称。
2 负责提交临床研究项目的立项评估。
3 参与临床研究项目的合同洽谈与签署。
4 负责提交伦理审查申请/报告。
5 按照医疗机构利益冲突政策,公开任何与临床研究项目相关的经济利益。
6 负责组织临床研究研究队伍,明确各研究岗位的职责分工并授权。
7 协助组织临床研究开始前的培训。
8 负责组织临床研究的实施,并对研究保持适当的监管。
9 本中心发生严重不良事件,研究者应在获知后15日内向伦理委员会报告;临床试验发生死亡,应在获知后7日内向伦理委员会报告。以注册为目的的药物临床试验遵守《药物临床试验质量管理规范》(2020)的规定,预期严重不良反应不要求向伦理委员会快速报告。
10 为避免研究对受试者的即刻危险而偏离方案,应在30天内向伦理委员会报告。
11 研究者收到申办者关于临床试验的最新安全信息报告后,应及时向伦理委员会报告。
12 研究者暂停或终止研究,应在7日内向申办者、伦理委员会、机构研究管理部门报告。
13 负责接受监查/稽查或检查,制定改进计划。
14 审核临床试验项目的总结报告,参加相关的答辩工作。
15 负责组织临床研究项目文件档案的管理。
二.研究人员的职责:
1 按照医疗机构利益冲突政策,公开任何与临床研究项目相关的经济利益。
2 负责以公平公正的方式招募受试者。
3 负责获取受试者参加研究的知情同意。
4 负责及时回应受试者的疑问、抱怨和要求;研究过程中发生影响试验风险/受益的事件、试验流程的修正或提前中止临床试验时,应及时告知受试者。
5 遵循法规和指南,遵循伦理委员会批准的方案开展研究工作。
6 负责观察记录受试者的医疗信息和研究数据,按方案规定使用试验药物或试验医疗器械。
7 负责做出与临床研究相关的医疗决定,采取必要的措施以保障受试者的安全。
8 本中心发生严重不良事件,研究者应在获知后15日内向伦理委员会报告;临床试验发生死亡,应在获知后7日内向伦理委员会报告。以注册为目的的药物临床试验遵守《药物临床试验质量管理规范》(2020)的规定,预期严重不良反应不要求向伦理委员会快速报告。
9 为避免研究对受试者的即刻危险而偏离方案,应在30天内向伦理委员会报告。
10 接受临床研究项目的监查/稽查;
11 做好临床研究项目文件档案的管理。
Copyright 2017 © 版权所有 温州医科大学附属眼视光医院 浙ICP备05076115号-3


技术支持:温州医科大学附属眼视光医院信息管理处 联科科技